 et sponsorisé par
et sponsorisé par 

Si les troubles respiratoires sont susceptibles d’affecter les bovins de tous âges, ils peuvent constituer un véritable problème chez les broutards de 6 à 8 mois destinés à l’engraissement, allotés en atelier et les veaux non sevrés durant leurs premiers mois de vie. En France, les maladies respiratoires sont les premières causes de mortalité chez les veaux allaitants de 20 jours à 2 ans d’âge.
De nombreux agents, bactériens ou viraux, souvent associés, sont responsables des bronchopneumonies infectieuse enzootiques (BPIE), ou complexe respiratoire bovin. Des facteurs environnementaux facilitent la diffusion de ces agents ou le passage d’un portage sain vers l’infection.
Les BPIE sont observables généralement autour de la saison hivernale, alors que les animaux sont en bâtiment. Lorsque toutes les conditions sont réunies – circulation d’agents infectieux, affaiblissement des défenses immunitaires et conditions environnementales délétères- les troubles peuvent apparaitre chez plusieurs animaux d’un même groupe. Le tableau clinique est généralement assez évocateur et comprend de l’hyperthermie, un abattement ainsi que des signes respiratoires d’intensité variable : dyspnée, toux et jetage séreux, avec des taux de morbidité et de mortalité qui peuvent être très élevés. La fréquence des maladies respiratoires augmente avec le regroupement d’animaux en provenance d’exploitations différentes. Son incidence est donc bien plus élevée dans les élevages engraisseurs, dans lesquels elle peut atteindre plus de 30 %, que dans les élevages naisseurs.
Quelques estimations liées aux BPIE :
Les BPIE sont la principale cause de perte économique en élevage allaitant à travers le monde.
En élevage, ces pertes sont imputables à :
Les BPIE surviennent à la faveur de la combinaison de plusieurs facteurs : la circulation de pathogènes respiratoires, la conformation particulière de l’appareil respiratoire des bovins et la présence d’éléments liés à l’environnement et à la gestion des animaux, contribuant à altérer leurs défenses immunitaires.
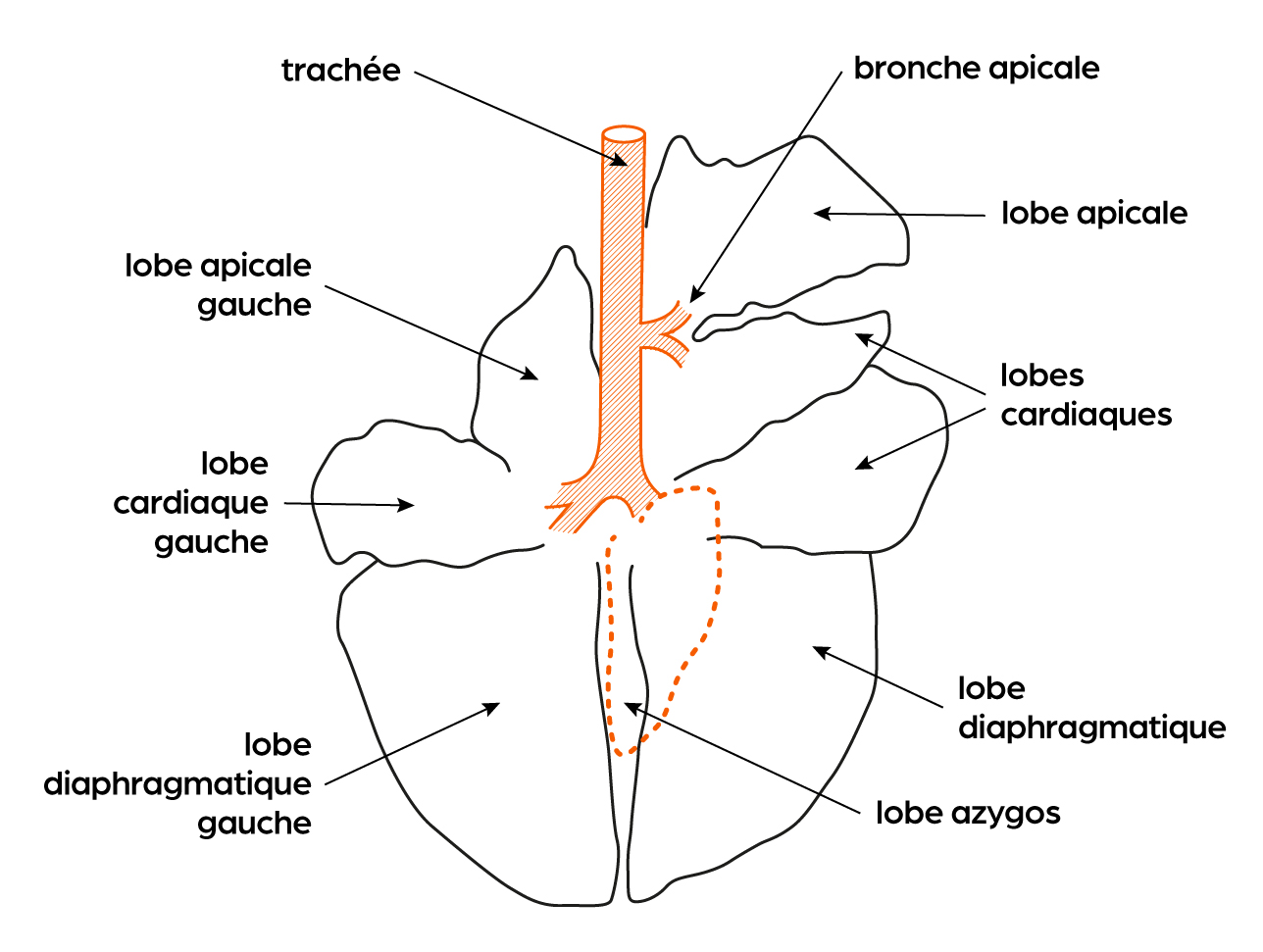
Plusieurs éléments, anatomiques ou physiologiques, prédisposent les bovins aux troubles respiratoires.
En outre, les jeunes bovins sont encore plus sensibles que leurs ainés aux troubles respiratoires, car jusqu’à l’âge de un an, leur système respiratoire est immature et les échanges respiratoires sont donc diminués.
Des facteurs liés à l’ambiance et à la conduite d’élevage sont susceptibles d’augmenter les risques de troubles respiratoires en élevage.
Ainsi, la température ambiante est un élément clé, la zone de confort thermique des veaux étant située entre 5 et 25 °C. Des températures trop basses favorisent la survie des pathogènes et entrainent une ischémie susceptible de diminuer la capacité respiratoire des bovins. De plus, des variations importantes de températures engendrent un stress susceptible d’affecter la fonction immunitaire.
La stagnation de l’air, liée à une ventilation insuffisante, favorise la concentration des pathogènes et entraine une saturation en gaz irritants pour les voies respiratoires, ammoniac et sulfure d’hydrogène. En revanche, une ventilation trop importante accentue la sensation de froid et irrite les voies respiratoires par dessication.
De manière générale, toutes les causes de stress sont des facteurs favorisant les troubles respiratoires, car elles ont un impact direct sur la fonction immunitaire : stress thermique, stress lié au transport, au sevrage, à l’allotement. Par ailleurs, l’allotement entraine le regroupement d’animaux de statut immunitaire et infectieux différent, ce qui facilite la circulation et la transmission des pathogènes.
Les pathogènes étant peu résistants dans l’environnement, la transmission s’effectue essentiellement par contact direct. L’intensification des systèmes de production a favorisé la circulation de ces agents en élevage.
Les bovins peuvent être porteurs sains de nombreux pathogènes impliqués dans les BPIE. La maladie clinique ne survient qu’à la faveur d’un déséquilibre entre les pathogènes et le microbiome. De récents travaux ont montré que des facteurs individuels pouvaient expliquer la sensibilité de certains animaux aux troubles respiratoires : une plus grande diversité bactérienne des microbiomes nasal et trachéal permettrait aux animaux de mieux résister à la colonisation des germes pathogènes.

Le virus syncitial bovin, est virus enveloppé à ARN du genre Pneumovirus (Paramyxoviridae). Il est proche du virus de la bronchiolite du nourrisson. Ce pathogène est fréquemment impliqué dans les troubles respiratoires des bovins. La transmission s’effectue par contact direct, de mufle à mufle ou via des aérosols. Des contaminations par des mains souillées sont également décrites. Les jeunes, ainsi que les adultes naïfs, sont les plus affectés. Après une période d’incubation de 2 à 5 jours, les animaux atteints peuvent présenter une hyperthermie, de l’abattement ainsi qu’une détresse respiratoire avec jetage. Dans les élevages non vaccinés, le taux de mortalité peut atteindre 40 % . En raison de son action cytopathogène sur l’épithélium respiratoire, le vRSV entraine une bronchite et une bronchiolite interstitielle avec consolidation pulmonaire.
La réponse immunitaire est principalement humorale, avec un pic d’IgA vers 10 jours post-infection et un pic d’IgG1 vers 30 jours. Après infection, la réponse cellulaire s’effectue via les lymphocytes cytotoxiques CD8+, les lymphocytes CD4+, étant présents chez les animaux vaccinés par voie parentérale.
Le virus parainfluenza bovin est un virus enveloppé, à ARN, du genre Respirovirus (Paramyxoviridae). Il se transmet entre bovins par contact étroit ou via les aérosols de jetage. Ce virus s’attache aux cellules hôtes grâce à l’hémagglutinine neuramidase, puis il pénètre la membrane cytoplasmique, avant de se répliquer. Les symptômes sont peu spécifiques : hyperthermie, toux, jetage, abattement modéré. Il est également à l’origine d’une baisse de l’immunité, facilitant les co-infections.
La durée de persistance de l’immunité est faible, les rappels vaccinaux doivent être fréquents.
Le B-CoV est un virus enveloppé à ARN, appartenant au genre Coronavirus (Coronaviridae) C’est un pathogène ubiquiste, présent partout dans le monde et impactant l’engraissement des jeunes bovins, le portage viral entrainant une diminution du GMQ. La transmission entre bovins s’effectue par contact direct, transmission oro-fécale ou via des aérosols. Il peut être responsable de syndrome entéritique chez les veaux de moins de 3 semaines et de troubles respiratoires (hyperthermie, dyspnée) en atelier d’engraissement. Selon certaines études, il pourrait avoir un rôle primaire dans les BPIE.
Le virus de la BVD est un petit virus à ARN, appartenant au genre Pestivirus (Flaviviridae). Le génotype 1, comprenant 16 sous types est majoritaire en France. La transmission horizontale s’effectue principalement par voie directe, mais la transmission via les matières biologiques est possible. La contamination par voie placentaire est également possible et selon le stade de gestation au moment de l’infection, peut donner naissance à un veau infecté permanent immunotolérant (IPI). Ce virus est un facteur favorisant de l’apparition de troubles respiratoires, en raison de l’immunodépression qu’il engendre.
Le BoHV-1 est un virus enveloppé à ADN, du genre Varicellovirus (Herpesviridae). A l’origine de graves pertes économiques dans les années 1970, cette maladie est maintenant peu présente cliniquement, grâce aux mesures de lutte mises en place en France depuis de nombreuses années. Pour être indemne d’IBR, un élevage doit mettre en place une quarantaine et un contrôle des animaux introduits ainsi que des contrôles sériques réguliers.
La contamination entre bovins s’effectue par contact direct, par voie aérienne sur de courtes distances, par voie sexuelle ou via des surfaces contaminées, grâce à une bonne persistance dans le milieu extérieur. C’est un cofacteur important des BPIE, en raison des dommages infligés au nveau de l’arbre respiratoire et de la diminution d’activité des cellules immunitaires. Outre les signe respiratoires, cette maladie peut entrainer des lésions oculaires, cutanées, digestives, nerveuses génitales ou mammaires.

Ce sont les agents bactériens les plus fréquemment rencontrés en cas de BPIE. Elles peuvent être à l’origine de troubles respiratoires seules, mais sont également des agents de surinfection. Les vaccins disponibles ne concernent que Mannheimia haemolytica et n’offrent pas de protection croisée avec les autres pasteurelles. Elles sont résistantes à de nombreuses familles d’antibiotiques.
Pasteurella multicida est un bacille à Gram négatif, capsulé, qui survit dans l’environnement sans s’y développer. La capsule limite la phagocytose et la sensibilité à la lyse. Le seul pathogène majeur est P. multocida subsp multocida. Parmi les 16 sérotypes existants, les sérotypes 2 et 5 engendreraient des septicémies hémorragiques alors que le sérotype 3 interviendrait dans le mal des transport et les BPIE des veaux. C’est également une bactérie commensale des voies respiratoires des bovins, en particulier des cavités nasales. Suite à une infection virale concomitante ou antérieure, cette bactérie opportuniste peut révéler son pouvoir pathogène. Les lésions, fibrino suppuratives, sont de type bronchoalvéolaire. Cette pasteurellose peut évoluer en bronchite obstructive chronique.
Il s’agit d’un bacille à gram négatif. Trois sérogroupes sont particulièrement présents en France : A1, A2, et A2. Le sérogroupe A6 est commensal dans les cavités nasales et le pharynx des bovins. En raison de nombreux facteurs de virulence, M. haemolytica est une excellente bactérie opportuniste des voies respiratoires profondes. Contrairement à P. multocida, elle sécrète une leukotoxine, qui perturbe les défenses immunitaires de l’hôte et favorise la colonisation du tractus respiratoire profond. Le lipopolysaccharide entraine la production de facteurs proinflammatoires et provoque des lésions vasculaires.
Selon plusieurs études, c’est la bactérie la plus identifiée chez les veaux allotés atteints de BPIE, et la première chez les veaux de moins de 2 mois en France.
C’est un bacille à gram négatif, non capsulé. C’est également un pathogène commensal de la sphère respiratoire. Les troubles respiratoires, en particulier bronchopneumonies aigues et chroniques, ne sont pas les seules conséquences de l’infection : septicémie, myocardite, méningo-encéphalite, arthrite, avortements et troubles de la fertilité sont également décrits.
Malgré l’absence de capsule, cette bactérie est capable de survivre dans l’environnement sous forme de biofilms, grâce à la synthèse d’un exopolysaccharide. Ce biofilm pourrait également expliquer en partie les formes chroniques de BPIE. La transmission est directe par contact ou indirecte via des matières contaminantes (jetage, mucus bronchique, sang…). Cette bactérie possède une protéine de surface à forte variabilité antigénique et dont l’interaction avec les IgE entraine une augmentation de la production d’histamine et donc une bronchostriction et une vasodilatation sanguine.
Mycoplasma bovis est une bactérie aérobie-anaérobie facultative, de la classe des Mollicutes (Mycoplasmacetae) intracellulaire et sans paroi. Bien que plus de 100 espèces de Mollicutes aient été isolées chez les bovins, Mycolplasma bovis est le principal mycoplasme isolé lors de troubles respiratoires chez les bovins dans les zones indemnes de péri-pneumonie contagieuse bovine, due à M. mycoides subsp. Mycoides.
La mycoplasmose respiratoire est un fléau économique, dont l’impact est estimé à 144 millions d’euros en Europe. Les traitements antibiotiques sont souvent inefficaces et une augmentation de la résistance est rapportée pour ce pathogène.
Cette bactérie n’est pas seulement responsable de troubles respiratoires, à savoir une bronchopneumonie exsudative , voire une nécrose du tissu pulmonaire, mais selon le siège de l’infection, elle peut être à l’origine de polyarthrites, de mammites, d’abcès méningé, de kérato-conjonctivites, d’otites, d’infections génitales et d’avortements. Chez les veaux, les lésions respiratoires graves sont souvent le signe d’une co-infection, essentiellement avec les pasteurelles. Les infections à mycoplasme ont souvent un caractère chronique dû à la variabilité des lipoprotéines de membrane, limitant la réponse immunitaire spécifique, à sa capacité d’invasion du cytoplasme et à la modulation de la réponse immunitaire de l’hôte. En effet, cette bactérie pourrait inhiber ou stimuler la réponse immunitaire de l’hôte par interaction directe entre protéines membranaires et cellules immunitaires.

Les conséquences économiques des BPIE tiennent à la fois aux pertes directes (mortalité, perte de production, coût des traitements) et aux pertes indirectes, imputables aux séquelles pulmonaires. Ces lésions, qui peuvent être présentes malgré la guérison clinique de l’animal, ont des conséquences sur la future production de l’animal. Le recours à une association d’un anti-inflammatoire et d’un antibiotique permet d’accélérer la résolution et de limiter les séquelles respiratoires.
En cas de BPIE, l’action des cellules inflammatoires, des endotoxines des bactéries gram -, et des cytokines, est responsable des symptômes cliniques : hyperthermie, apathie, anorexie, et altération de la fonction pulmonaire. Même si la thérapie est un succès, les lésions pulmonaires (fibrose, pneumonie catarrhale chronique, pneumonie fibrineuse) sont des séquelles courantes des BPIE. Les lésions chroniques sont présentes à l’abattoir sur de nombreux animaux traités ou non, avec des conséquences délétères sur la production future (lait, GMQ, reproduction…). En effet, la présence de lésions pulmonaires est associée à une diminution significative du poids de la carcasse.
L’association d’un antimicrobien et d’un anti-inflammatoire permet donc à la fois de lutter contre les agents infectieux respiratoires bactériens primaires ou secondaires et contre la tempête inflammatoire, déclenchée par la présence de pathogènes, la libération de toxines bactériennes et de cytokines.
Les macrolides montrent une activité immunomodulatrice in vitro qui pourrait expliquer leur efficacité sur le terrain. Les macrolides et en particulier la tulathromycine, modulent l’activité des neutrophiles et des macrophages dans le sens pro-résolutif, par la diminution de la sécrétion de médiateurs pro-inflammatoires (leucotriènes B4, CXCL-8), l’augmentation de la production de médiateurs pro-résolution, l’induction de l’apoptose des neutrophiles, l’augmentation de l’efférocytose des macrophages, etc.
Des études humaines ont également montré l’utilité des macrolides dans la lutte contre les virus respiratoires, et notamment le virus respiratoire syncitial humain, responsable de la bronchiolite.
Différents AINS ont démontré des effets bénéfiques à court terme en association avec des antibiotiques dans des études terrain, avec notamment un contrôle amélioré de l’hyperthermie et une amélioration de la fréquence respiratoire en post-traitement immédiat comparée à un traitement antibiotiques seul.
Enfin, une récente étude a montré que l’administration concomitante de thulatromycine et de kétoprofène permet un meilleur contrôle de l’hyperthermie, et une amélioration plus rapide des signes cliniques que l’administration de thulatromycine seule.

L’inflammation est une réponse de l’organisme à l’agression mais elle doit être limitée dans le temps et en intensité au risque de devenir néfaste. Trois phases sont décrites :
Si les cellule de l’immunité sont dépassées par le grand nombre de bactéries, la phase de résolution est retardée. Les bactéries présentes dans l’appareil respiratoire libèrent des toxines responsables de la nécrose des neutrophiles, qui éclatent en libérant leur contenu, à savoir des composés cytotoxiques (radicaux oxygénés) et de médiateurs pro-inflammatoires (leucotriène B4 ou lnterleukine8). La réaction inflammatoire est de plus en plus marquée, avec l’apparition de fibrine, qui stimule cellules de l’inflammation et la libération de nouveaux médiateurs.
Cela peut conduire à l’apparition de zones sous perfusées, nécrotiques, et à la diminution de la capacité respiratoire. L’évolution devient fatale si ce phénomène n’est pas régulé. Elle peut également donner lieu à une réaction subaiguë avec une phase suppurative, puis chronique. La résolution des symptômes peut s’accompagner de séquelles.
De nombreux mécanismes interviennent dans la cascade inflammatoire. Ainsi, le métabolisme de l’acide arachidonique, présent dans les phospholipides membranaires, occupe une place importante dans le processus inflammatoire. Il est métabolisé par les lipo-oxygénases (LOX), intervenant dans la production des leucotriènes, et par les cyclo-oxygénases (COX), intervenant dans synthèse des prostaglandines (PG) et du thromboxane.
Les enzymes Cox sont de deux types :

L’examen clinique est la première étape du diagnostic. Il ne permet pas de déterminer le ou les agents pathogènes en cause, mais permet de juger de la sévérité et de la localisation des lésions. Les principaux signes cliniques des BPIE sont l’hyperthermie, l’abattement, l’anorexie, la toux, le jetage et dyspnée. Plusieurs animaux sont généralement atteints dans un lot.
Des études ont montré que l’échographie pulmonaire peut s’avérer un outil utile pour évaluer objectivement la prévalence réelle des maladies respiratoires au sein d’un l’élevage. De plus, dans le cadre d’un suivi, cet examen permettrait de valider l’efficacité des mesures curatives et préventives mises en place. À l’échelle de l’individu, l’échographie thoracique permet de qualifier les lésions pulmonaires, de noter leur gravité et de préciser le pronostic, afin de déterminer le devenir de l’animal. Elle est pratiquée sur animal debout, avec les sondes linéaires utilisées classiquement par voie transrectale.
L’autopsie est également un examen peu couteux, qui permet de déterminer le type de bronchopneumonie (interstitielle ou alvéolaire), l’étendue et la gravité de la maladie. Certains tableaux lésionnels peuvent orienter le diagnostic étiologique ; ainsi, des foyers de nécrose font suspecter la présence de Mannheimia haemolytica. Cependant, le diagnostic de certitude passe par des analyses dédiées. Un prélèvement du poumon peut alors être réalisée à l’occasion de l’autopsie. Dans l’idéal, il comportera un lobe présentant à la fois une zone lésée et non lésée pour la recherche virale et bactériologique. Attention toutefois à la contamination environnementale et au délai d’acheminement.
Les examens de laboratoires sont indispensables pour caractériser le ou les agents étiologiques en cause. La sérologie est peu utile, car le prélèvement est doit être réalisé. La culture bactérienne permet de réaliser un antibiogramme, pour améliorer la valeur prédictive du traitement, mais avec des résultats tardifs. La RT-PCR autorise le diagnostic précoce des pathologies respiratoires. Outre le prélèvement à l’autopsie, les prélèvements, à effectuer sur les animaux en hyperthermie, peuvent être de plusieurs natures :

Le traitement des bronchopneumonies infectieuses bovine repose essentiellement sur un traitement anti-infectieux, pour lutter contre les bactéries pathogènes primaires ou responsables de surinfection en cas d’atteinte virale primaire et sur un traitement anti-inflammatoire, destiné à combattre la tempête inflammatoire néfaste au rétablissement de l’animal.
Le traitement antibiotique de première intention doit cibler les pasteurelles, souvent en cause ou à l’origine de surinfections. De nombreuses résistances sont décrites chez les mycoplasmes, les molécules récentes sont donc à privilégier. L’antibiotique choisi doit diffuser au lieu d’infection et être actif sur les pathogènes respiratoires. Toutefois, l’observance du traitement est capitale pour améliorer les chances de guérison, et limiter l’apparition d’antibiorésistances.
Lors de pathologies respiratoires, l’usage d’anti-inflammatoires est nécessaire. Il a un objectif double : améliorer la distribution des antibiotiques dans l’organisme et calmer la tempête inflammatoire consécutive à la colonisation des voies respiratoires. Les anti-inflammatoires non stéroïdiens sont à privilégier, en raison des effets immunosuppresseurs des anti-inflammatoires stéroïdiens.
La métaphylaxie consiste, selon la définition de l’Agence nationale de sécurité sanitaire (Anses), à « traiter des animaux cliniquement malades et les autres animaux du même groupe, encore cliniquement sains, mais dont la probabilité d’être infectés est forte à cause du contact étroit avec les animaux malades ». Sur le terrain, elle est généralement mise en œuvre lorsque 10 à 15 % du cheptel (ou du lot) est touché. Le traitement des animaux qui présentent des symptômes s’accompagne ainsi du traitement précoce des cas contacts qui ne les expriment pas encore.
Lorsqu’un lot de jeunes bovins est touché, l’administration précoce du traitements est la clé de sa réussite. Les animaux malades doivent être identifiés et traités avec soin. Cela nécessite une gestion fine de l’élevage et une contention individuelle des animaux pour l’administration des traitements. Leur observance doit donc être scrupuleusement respectée, tant au niveau de la posologie que du rythme d’administration. De plus, les animaux, souvent jeunes, ont peu l’habitude d’être manipulés ; chaque intervention constitue donc à la fois un danger pour les manipulateurs mais également une source de stress pour les animaux, déjà fragilisés. L’utilisation de molécules longue action est donc un avantage, à la fois pour l’observance du traitement, mais aussi pour la tranquillité des éleveurs et des animaux. Une mauvaise observance peut entrainer de lourdes pertes économiques, par échec thérapeutique et risque de chronicité des lésions mais favorise également l’apparition d’antibiorésistance.

En élevage bovin, a prévention des maladies respiratoires passe par la vaccination. Le choix des formes et des valences vaccinales offre un large choix pratique à l’éleveur et son vétérinaire, et permet d’adapter les protocoles vaccinaux à la situation de chaque élevage. Ceux-ci peuvent être dirigés vers les veaux ou vers les mères, l’immunité passive induite par le transfert colostral permettant une protection efficace du jeune veau jusqu’au développement de son immunité propre.
LLa vaccination contre les maladies virales respiratoires est la plus pratiquée chez les bovins : en 2020, 76 % des jeunes bovins de moins de 1 an étaient vaccinés contre le virus syncitial bovin (RSV) et contre le parainfluenzavirus de type 3. La vaccination contre les pasteurelles ne concerne que 31 % d’entre eux. Il n’existe pas, à l’heure actuelle, de vaccins commerciaux contre les mycoplasmoses bovines. Côté BVD, le statut des troupeaux est de mieux en mieux suivi et la politique de vaccination dépend des départements : 23 % des bovins adultes sont vaccinés contre cette maladie. La rhinotrachéite infectieuse bovine est également en recul, grâce à un assainissement progressif des cheptels, et aujourd’hui, seuls 3 % des bovins adultes sont vaccinés, bien que l’intérêt de la vaccination totale des cheptels soit de plus en plus reconnu. En revanche, les veaux de boucherie sont peu protégés contre les virus et bactéries respiratoires, la vaccination ne concernant que 1,3 % d’entre eux.
Il existe deux types de vaccins : les vaccins vivants inactivés, qui contiennent de fortes concentrations d’antigènes ainsi que des adjuvants et boosters et les vaccins atténués, dont les antigènes ont la capacité de se répliquer sans provoquer la maladie.
Les protocoles vaccinaux peuvent être dirigés vers les veaux ou vers les mères. En outre, les vaccins disponibles pour lutter contre les maladies respiratoires sont nombreux ; ils peuvent contenir une ou plusieurs valences concernant les maladies respiratoires : RSV, PI3, BVD, IBR, coronavirus, pasteurelles. Le choix des valences sera établi en fonction des antécédents de l’élevage. Quoi qu’il en soit, la vaccination doit être effectuée sur des animaux sains, bien nourris, en limitant le stress, susceptible de limiter la réponse immunitaire et notamment la production d’anticorps. En théorie, la vaccination doit être éloignée d’autres événements stressants ou douloureux (écornage, castration, sevrage…).
La vaccination des mères lors de la gestation vise à protéger les jeunes jusqu’au développement de leur propre immunité. Il s’agit de la protection par immunité passive qui est conditionné par la qualité de la prise colostrale. Le colostrum doit ainsi être distribué au veau au cours des premières heures de vie, et en quantité suffisante. Cette protection passive par transfert de l’immunité colostrale est de courte durée (durée de demi-vie des IgG1 de 16 à 38 jours, IgM de 4 jours et 2.5 jours pour les IgA).
La vaccination par immunisation active peut s’effectuer chez les jeunes en fonction du contexte de l’élevage. Ils existe alors une possibilité d’interférence de la vaccination des jeunes ayant une immunité passive. La vaccination intranasale, à action locale, permet de s’affranchir de ce risque d’interférences, elle peut être effectuée à partir de 9 jours d’âge mais ne concerne que les deux principaux virus (RSV et PI3). En revanche, elle n’offre une durée de protection que de douze semaines. La vaccination des jeunes par voie parentérale est également possible, généralement à partir de 2 semaines, mais il convient alors de se référer au RCP. La durée de l’immunité est généralement de 6 mois, en fonction des vaccins et des valences.

Lorsque les troubles respiratoires sont récurrents en élevage, le vétérinaire doit vérifier plusieurs éléments de la conduite d’élevage, mais aussi des bâtiments (figure).
La conduite d’élevage doit assurer un bon développement de l’immunité chez les jeunes. Cela passe par une prise suffisante d’un colostrum de bonne qualité dans les premières heures suivant la naissance. En pratique, le veau doit boire 10 % de son poids en colostrum au cours des 24 h suivant le vêlage, et au moins 1,5 l au cours des deux premières heures En effet, après 24 heures, le tube digestif du veau devient imperméable aux immunoglobulines contenues dans le colostrum. En élevage allaitant, la tétée des premières heures doit être surveillée. En élevage laitier, la constitution d’une banque de colostrum congelé est une solution intéressante. Elle sera plutôt constituée avec des multipares en bonne santé, qui produisent un colostrum de meilleure qualité. Celle-ci peut être vérifiée à l’aide d’un pèse-colostrum.
Les mesures de biosécurité doivent être respectées. Elles passent d’abord par la gestion des introductions d’animaux, avec la connaissance du statut sanitaire de l’élevage de provenance et la mise en place d’une quarantaine à l’arrivée. De même, les mélanges d’animaux d’âges (et donc de statut sanitaire) différents doivent être évités. Enfin, toute contamination extérieure doit être limitée : désinfection du matériel d’élevage commun, limitation des interventions dans le bâtiment des jeunes, installation d’un pédiluve…
La tonte de la ligne du dos des veaux à partir de 2 mois pourrait également limiter l’accumulation d’humidité par transpiration ou condensation. Elle s’effectue des épaules à base de la queue sur une largeur de 10 à 20 cm.
La conception du bâtiment influe directement sur l’ambiance. Les bâtiments anciens offrent généralement une bonne isolation mais des ouvertures insuffisantes alors que les plus récents bénéficient de grands volumes, qui restent difficiles à chauffer. Des aménagements simples peuvent alors parfois suffire.
Les jeunes veaux sont sensibles au froid, à l’humidité, aux courants d’air. De plus, la présence de gaz irritants, comme l’ammoniac produit de la fermentation des litières, fragilise leur muqueuse respiratoire, la rendant plus sensible aux infections.
Dans le bâtiment des veaux, le volume d’air doit être compris entre 8 à 10 m2 par animal, avec un renouvellement suffisant, d’environ de 150 m3 d’air par veau et par heure. La température de confort des veaux, comprise entre 5 et 25° jusqu’à 1 mois, est importante, mais le vétérinaire tiendra compte de la température ressentie. Celle-ci dépend de l’hygrométrie, qui doit être inférieure à 80 % et de la vitesse de l’air, qui doit être inférieure à 0.25 m/s. L’aération doit donc être suffisante pour permettre le renouvellement de l’air, tout en évitant les courants d’air. L’utilisation de fumigène permet d’évaluer la ventilation d’un bâtiment.
La litière doit être renouvelée fréquemment, pour éviter la fermentation et le dégagement important d’ammoniac. Des valeurs de moins de 5 ppm d’ammoniac dans l’air sont idéales, elles correspondent à une odeur à peine perceptible.
Si la ventilation naturelle est insuffisante, une ventilation mécanique peut être envisagée.